SEMANGAT BERPRESTASI
YUUUKK
BELAJARRR...!!!!!
TUJUAN
PEMBELAJARAN
4. Siswa dapat menjelaskan
kulit dan subkulit serta hubungannya dengan bilangan kuantum.
5. Siswa dapat menggunakan prinsip Aufbau untuk menuliskan konfigurasi elektron dan dengan
orbital
6. Siswa dapat menggunakan aturan Hund untuk menuliskan konfigurasi elektron dan diagram
orbital
7. Siswa dapat mengguanakan Azas larangan Pauli untuk menuliskan konfigurasi elektron dan
diagram orbital
5. Siswa dapat menggunakan prinsip Aufbau untuk menuliskan konfigurasi elektron dan dengan
orbital
6. Siswa dapat menggunakan aturan Hund untuk menuliskan konfigurasi elektron dan diagram
orbital
7. Siswa dapat mengguanakan Azas larangan Pauli untuk menuliskan konfigurasi elektron dan
diagram orbital
G. Konfigurasi Elektron
Suatu cara penulisan yang
menunjukkan distribusi elektron dalam orbital-orbital pada kulit utama dan
subkulit disebut konfigurasi elektron. Pada penulisan konfigurasi
elektron perlu dipertimbangkan tiga aturan (asas), yaitu prinsip Aufbau, asas
larangan Pauli, dan kaidah Hund.
1. Prinsip Aufbau
Elektron-elektron dalam
suatu atom berusaha untuk menempati subkulit – subkulit yang berenergi rendah,
kemudian baru ke tingkat energi yang lebih tinggi. Dengan demikian, atom berada
pada tingkat energi minimum. Inilah yang disebut prinsip Aufbau.
Urutan-urutan tingkat energi
ditunjukkan pada gambar 1.10. Jadi, pengisian orbital dimulai dari orbital 1s,
2s, 2p, dan seterusnya. Pada gambar dapat dilihat bahwa subkulit
3d mempunyai energi lebih tinggi daripada subkulit 4s. Oleh
karena itu, setelah 3p terisi penuh maka elektron berikutnya akan
mengisi subkulit 4s, baru kemudian akan mengisi subkulit 3d. Hal
yang sama berlaku untuk 5s dan 4d serta 6s dan 4f.
Dengan mengingat bahwa orbital s, p, d, dan f masing – masing maksimal ditempati oleh 2, 6, 10, dan 14
elektron maka orbital – orbital menurut kenaikan tingkat energi ditulis sebagai
berikut.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Contoh:
1) 11Na
Konfigurasi
elektron: 1s2 2s2 2p6 3s1
2) 17Cl
Konfigurasi
elektron: 1s2 2s2 2p6 3s2 3p5
2. Larangan Pauli
Pada tahun 1928, Wolfgang
Pauli (1900 – 1958) mengemukakan bahwa tidak ada dua elektron dalam satu
atom yang boleh mempunyai keempat bilangan kuantum yang sama. Dua elektron yang
mempunyai bilangan kuantum utama, azimuth, dan magnetik yang sama dalam satu
orbital, harus mempunyai spin yang berbeda. Kedua elektron tersebut berpasangan.
Setiap orbital mampu menampung maksimum
dua elektron. Untuk mengimbangi gaya tolak-menolak di antara
elektron-elektron tersebut, dua elektron dalam satu orbital selalu berotasi
dalam arah yang berlawanan.
Contoh:
A. 1H:
Atom hidrogen mempunyai satu elektron
1s1
l = 0 s = +1/2
B. 2He
: Elektron pertama atom helium mempunyai harga keempat bilangan kuantum yang
sama
dengan hidrogen. Bilangan kuantum elektron kedua helium adalah sebagai berikut.
sama
dengan hidrogen. Bilangan kuantum elektron kedua helium adalah sebagai berikut.
1s2
l = 0 s = - 1/2
C.3Li
: Elektron pertama dan kedua dari atom litium mempunyai harga keempat bilangan
kuantum
yang sama dengan elektron pertama dan elektron kedua helium. Bilangan kuantum
elektron ketiga litium adalah sebagai berikut.
kuantum
yang sama dengan elektron pertama dan elektron kedua helium. Bilangan kuantum
elektron ketiga litium adalah sebagai berikut.
l = 0 s = + 1/2
Demikian seterusnya, sehingga satu orbital maksimal terisi dua elektron dan tidak ada elektron dalam satu atom yang mempunyai harga keempat bilangna kuantum yang sama.
2. Kaidah Hund
Untuk menyatakan distribusi
elektron-elektron pada orbital-orbital dalam suatu subkulit, konfigurasi
elektron dapat dituliskan dalam bentuk diagram orbital. Suatu orbital
dilambangkan dengan strip, sedangkan dua elektron yang menghuni satu orbital
dilambangkan dengan dua anak panah yang berlawanan arah. Jika orbital hanya
mengandung satu elektron, anak panah dituliskan mengarah ke atas.
Dalam kaidah Hund,
dikemukakan oleh Friedrich Hund (1894 – 1968) pada tahun 1930,
disebutkan bahwa “pengisian elektron pada orbital – orbital yang tingkat
energinya sama, elektron tidak berpasangan terlebih dahulu sebelum orbital –
orbital lainnya masing – masing terisi satu elektron.
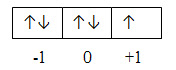
Orbital
kosong (tidak mengandung elektron)
Orbital setengah penuh (mengandung elektron yang tidak berpasangan)
Orbital
penuh (mengandung pasangan elektron)
Contoh Soal:
Susunlah
konfigurasi elektron dan tentukan keempat bilangan kuantum untuk elektron
terakhir dari atom:
a.
9F
b.
27Co
Jawab:
a. Konfigurasi
elektron 9F : 1s2 2s2 2p5
Elektron terakhir terletak pada 2p5
n = 2 m = 0
l = 1 s = -1/2
b.
Konfigurasi elektron 27Co : 1s2 2s2 2p6 3s2 3p6 4s2 3d7
n = 3 m = - 1
l = 2 s =
-1/2
Penulisan konfigurasi elektron dapat
ditulis dengan cara penyingkatan, yaitu dengan menggunakan konfigurasi elektron
gas mulia yang terdekat. Konfigurasi elektron gas mulia dapat dilihat pada
tabel 1.4.
Tabel
1.4 Konfigurasi elektron gas mulia
Gas
Mulia
|
Konfigurasi
Elektron
|
2He
|
1s2
|
10Ne
|
1s2 2s2 2p6
|
18Ar
|
1s2 2s2 2p6 3s2 3p6
|
36Kr
|
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
|
54Xe
|
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
|
86Rn
|
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6
|
Penulisan konfigurasi diatas adalah berdasarkan urutan tingkat energi sesuai dengan aturan Aufbau. Cara lain untuk penulisan konfigurasi elektron adalah berdasarkan pada kulit, dimana subkulit – subkulit dari kulit yang sama dikumpulkan sesudah itu baru subkulit dari kulit berikutnya.
Berikut ini contoh penulisan konfigurasi
elektron dengan cara menyingkat, dengan menggunakan konfigurasi gas mulia.
a. 12Mg
: [Ne] 3s2
b. 26Fe : [Ar] 4s2 3d6
c . 56I : [Kr] 5s2 4d10 5p5
atau [Kr] 4d10 5s2 5p5
Kestabilan Subkulit d yang Terisi Penuh atau Setengah Penuh
Terdapat
beberapa penyimpangan pengisian elektron berdasarkan asas aufbau dengan yang
ditemukan berdasarkan percobaan. Contohnya, yaitu konfigurasi elektron kromium
(Z=24) dan tembaga (Z=29). Konfigurasi elektron Cr dan Cu berdasarkan asas
aufbau adalah sebagai berikut.
Cr
(Z=24) : [Ar] 3d4 4s2
Cu
(Z=29) : [Ar] 3d9 4s2
Konfigurasi elektron Cr dan Cu
berdasarkan percobaan adalah sebagi berikut.
Cr
(Z=24) : [Ar] 3d5 4s1
Cu
(Z=29) : [Ar] 3d10 4s1
Sebagaimana
dapat diperiksa, konfigurasi dengan dua subkulit terakhir d4 s2 atau d9s2, cenderung berubah menjadi
menjadi d5 s1
atau d10 s1. Ternyata, subkulit d yang terisis penuh (d10) atau setengah penuh(d5) lebih stabil.
Elektron
valensi
Elektron
valensi adalah elektron yang dapat digunakan untuk pembentukan ikatan kimia. Unusr–unsur golongan utama hanya menggunakan elektron kulit terluar untuk berikatan,
yaitu elaktron pada subkulit ns dan np (n= kulit terluar); sedangkan unsur
transisi dapat menggunakan elektron (n-1)d,
di samping elektron kulit terluarnya. Jadi, elektron valensi unsur transisi
adalah elekron pada subkulit (n-1) d
dan ns.
Contoh soal:
Tentukanlah kulit valensi dan jumlah
elektron valensi unjusr – unsur berikut.
a.
Na (Z=11)
b.
Cl (Z=17)
Jawab:
Kulit
valensi unusr golongna utama : ns dan
np
Kulit
valensi unusr transisi : (n-1)d dan ns
a.
Na (Z=11)
Konfigurasi
elektron Na (Z=11) : 1s2 2s2 2p6 3s1
atau [Ne] 3s1
Kulit valensi : 3s
Jumlah elektron
valensi = 1
b. Cl (Z=17)
Konfigurasi
elektron Cl (Z=17) : 1s2 2s2 2p6 3s2 3p5
atau [Ne] 3s2 3p5
Kulit valensi : 3s dan 3p
Jumlah elektron
valensi : 2 + 5 = 7
SOAL
DISKUSI
1.
Jelaskan beberapa istilah berikut ini!
a. Prinsip Aufbau
b. Kaidah Hund
c. Asas larangan Pauli
2.
Tuliskan konfigurasi beberapa unsur berikut ini, kemudian tentukan jumlah
elektron pada masing-
masing
kulit atomnya!
a. K (Z = 19)
b. Se (Z = 34)
3.
Tuliskan konfigurasi elektron dari ion-ion berikut dan tentukan keempat
bilangan kuantum untuk
elektron
terakhir dari atom.
a. Fe3+ (Z = 26)
b. Cr3+ (Z = 24)
c. O2-
(Z = 8)
d. Br– (Z = 35)
Selamat
Bekerjaaaa....

 Home
Home











PENJELASAN SUBKULIT F DONG....!
ReplyDeleteMakasih!!sangat membantu saya dalam mengerjakan tugas
ReplyDeleteThis is a great article thanks for sharing this informative information. I will visit your blog regularly for some latest post. I will visit your blog regularly for Some latest post. raw chemical materials jakarta
ReplyDelete